Este es el nuevo y último tema del tercer periodo y esta fundamentado en los temas anteriores: Enlace químico, nomenclatura y formulación química e inclusive, se entiende a través del concepto de mezclas y soluciones.
En el siguiente enlace serás llevado a una página donde encontrarás la Definición de una reacción química y en función de ello encontrarás una actividad con la cual podrás verificar si comprendiste el concepto de reacción química.
Las siguientes evidencias nos permitirán identificar cuando ha ocurrido un cambio químico al combinar dos sustancias:
- Formación de un precipitado, es decir, se genera una sustancia insoluble en el medio

- Producción o liberación de gases, como cuando se mezcla un Alka-Seltzer en agua, o combinamos vinagre con bicarbonato de sodio
- Cambio de color, como cuando dejamos una manzana picada por mitad, a la interperie
- Cambio de olor y sabor, como en la fermentación de los alimentos y producción de bebidas alcohólicas
- Variación en la temperatura, bien sea que aumente o descienda.
TIPOS DE REACCIONES QUÍMICAS
Según el tipo de elemento o compuesto que se tenga o que se combine, se tendrán 4 tipos de reacciones químicas:
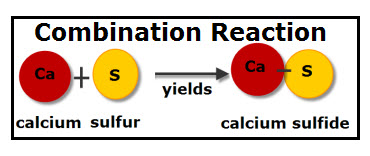
1. Combinación o síntesis, en la cual dos elementos o sustancias puras se combinan para dar un compuesto:
En el siguiente vídeo Magnesio y Oxígeno encontraremos al elemento Magnesio presentado en la naturaleza como una cinta. Esta cinta es sometida a la llama, que contiene Oxígeno, arde con un blanco brillante, y los restos o ceniza corresponden al Óxido Magnesico que se ha producido:
Mg + O2 → MgO
2. Descomposición, donde se tiene una sustancia compuesta y a partir de la electricidad o la presencia de calor, se separa en sus componentes fundamentales:
A continuación se mostrará la reacción de descomposición del agua en sus componentes fundamentales: Hidrógeno y Oxígeno, a través de la presencia de la electricidad:
P.D.: En el minuto 1.52 se observa el tamaño de los gases (el hidrógeno mucho más pequeño que el oxígeno, como el modelo atómico de Dalton que establece que cada elemento tiene un tamaño definido en función de su número atómico), tal y como se mencionó en clases.
El siguiente ejemplo muestra la descomposición del Sulfato de Cobre (II) pentahidratado que utilizamos en el laboratorio en el segundo momento para preparar soluciones. En él se muestra que dicha sal es sometida al calor y éste hace que el agua se evapore del compuesto, por lo cual queda el sulfato sólo; finalmente le agregan nuevamente agua y, recobra su color:
🔺
CuSO4 * 5H20 → CuSO4 + 5H2O↗
P.D.: El triángulo significa calor, y la flecha diagonal significa que se evapora
En este otro vídeo, podemos observar la descomposición del Peróxido de Hidrógeno (agua oxigenada). A temperatura ambiente, el se descompone pero la reacción es muy lenta, sin embargo, en el vídeo utilizan un catalizador (sustancia que acelera el proceso) y demuestran que el hidrógeno liberado arde dentro del medio. Posteriormente hacen otra reacción de descomposición utilizando el Permanganato de Potasio el cual se reduce a dióxido de manganeso y es capaz de descomponer el peróxido, liberando gran cantidad de energía (reacción exotérmica) así como agua y los gases respectivos.
3. Desplazamiento, en la que un elemento en un compuesto es sustituído por otro elemento más reactivo que él, quedando este último libre:
En los siguientes vídeos, encontrará ejemplos de reacciones de desplazamiento. Usualmente este tipo de reacciones es utilizada en la comprobación de la reactividad química, es decir, se corrobora que elemento metálico es más reactivo que otro en cuanto a la combinación con un elemento. Para ello se utilizan ácidos o sales de un compuesto, y se va agregando el elemento para rectificar cuál es más reactivo que otro en cuanto a ceder sus electrones en el enlace químico respectivo.
4. Doble descomposición o Doble desplazamiento, en el cual, dadas dos sustancias compuestas, se combinan entre sí, generando otras dos sustancias con propiedades totalmente distintas a las iniciales:
En el siguiente vídeo, podrá observarse la reacción entre el Ioduro de Potasio y el Cloruro de Mercurio (II), generando posterior a la combinación un cambio de coloración, indicando la presencia de un cambio químico en las sustancias. La ecuación que sigue la reacción es:
KI + HgCl2 → HgI2 + KCl
KI + HgCl2 → HgI2 + KCl
En este otro vídeo, encontrará una reacción donde se forma un precipitado entre el Sulfato de Sodio y el Cloruro de Bario (a partir del minuto número 1.44):
Na(SO4) + BaCl2 → Ba(SO4) + NaCl








.jpg)



No hay comentarios:
Publicar un comentario